Какво е анод и катод - просто обяснение
Електрохимия и галванопластика
В електрохимията има две основни секции:
- Галванични клетки - производството на електричество чрез химическа реакция. Тези елементи включват батерии и акумулатори. Те често се наричат химически източници на ток.
- Електролиза - въздействието върху химическа реакция с електричество, с прости думи - с помощта на източник на енергия се стартира реакция.
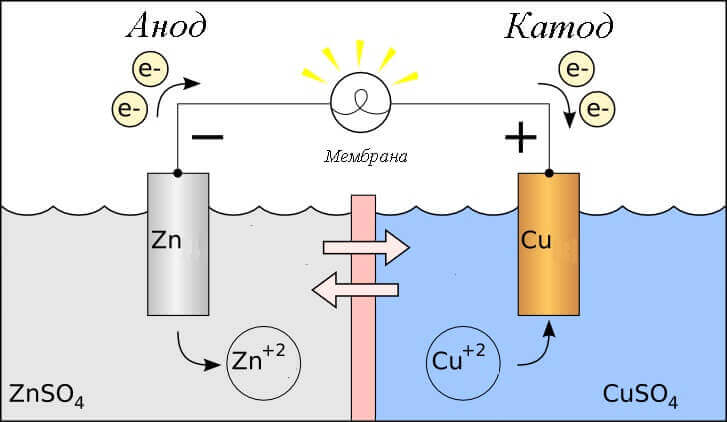
Помислете за редукционната реакция в галванична клетка, тогава какви процеси протичат върху нейните електроди?
- анод - електрода, на който се наблюдава окислителна реакциятова е тойдава електрони, Извиква се електродът, върху който протича реакцията на окисляване редуциращ агент.
- катод - електрода, на който тече реакция на възстановяванетова е тойприема електрони, Извиква се електродът, на който възниква редукционната реакция окислител.
Това поставя въпроса - къде е плюсът и къде е минусът на батерията? Въз основа на дефиницията на галванична клетка анодът дава електрони.
Важно! GOST 15596-82 дава официално определение на наименованията на заключенията на химични източници на ток, накратко, след това плюс на катода и минус на анода.
В този случай се взема предвид потокът на електрическия ток. по протежение на проводника на външната верига от окислител (катод) за редуктор (Анод), Тъй като електроните във веригата протичат от минус към плюс, а електрическият ток е обратно, тогава катодът е плюс, а анодът е минус.
Предупреждение: токът винаги тече в анода!
Или същото в диаграмата:
Електролиза на батерията или процес на зареждане
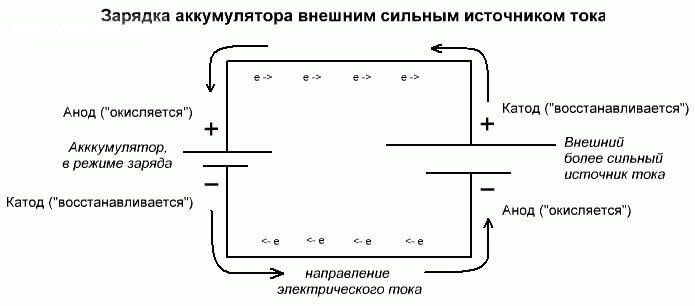
Тези процеси са подобни и обратни на галваничната клетка, тъй като тук не енергията идва от химическа реакция, а по-скоро се получава химическа реакция от външен източник на електричество.
В този случай плюс захранването също се нарича катод и минус анода. Но контактите на акумулаторната галванична клетка или електродите на електролизатора вече ще имат противоположни имена, нека да видим защо!
Важно! Когато се освободи галванична клетка, анодът е минус, катодът е плюс и обратно при зареждане.
Тъй като токът от положителния терминал на източника на захранване се подава към положителния извод на батерията, последният вече не може да бъде катод.Като се позоваваме на горното, можем да заключим, че в този случай електродите на батерията условно сменят местата си при зареждане.
След това през електрода на заредена галванична клетка, в която се влива електрически ток, той се нарича анод. Оказва се, че при зареждане на батерията плюсът става анод, а минусът - катодът.
галванотехника
Процесите на отлагане на метали в резултат на химическа реакция под въздействието на електрически ток (по време на електролиза) се наричат галванично инженерство. Така светът получи посребрени, позлатени, хромирани или покрити с бижута и детайли от други метали. Този процес се използва както за декоративни, така и за приложни цели - за подобряване на корозионната устойчивост на различни компоненти и възли на механизми.
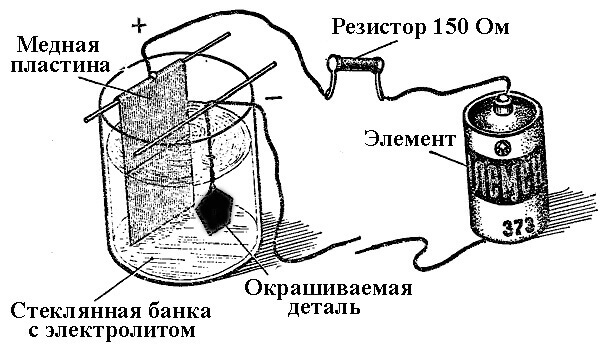
Принципът на работа на галваничните инсталации се състои в използването на разтвори на соли на елементите, които ще покрият частта като електролит.
При галванопластиката анодът също е електрод, към който е свързан положителният изход на източника на енергия, съответно катодът в този случай е минус. В този случай металът се отлага (редуцира) върху отрицателния електрод (реакция на редукция). Тоест, ако искате да направите позлатен пръстен със собствените си ръце - свържете отрицателния изход на захранването към него и го поставете в контейнер със съответното решение.
В електрониката
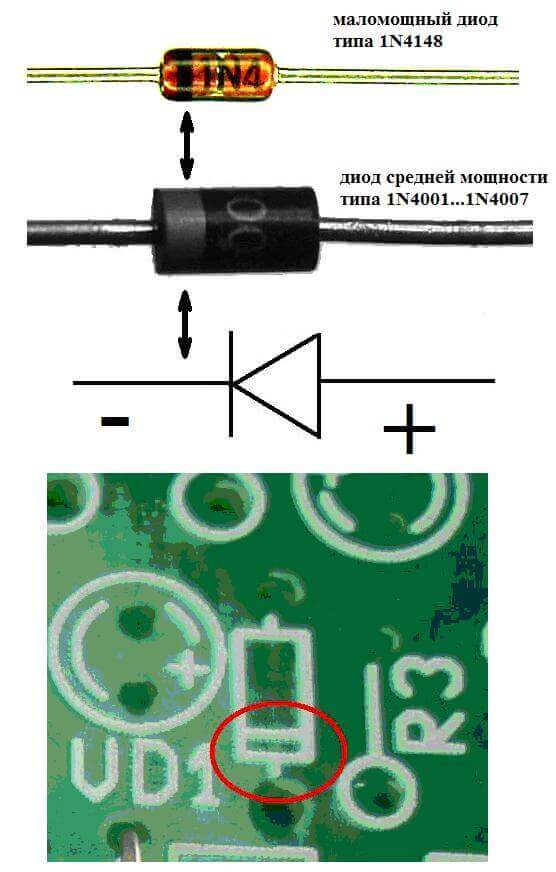
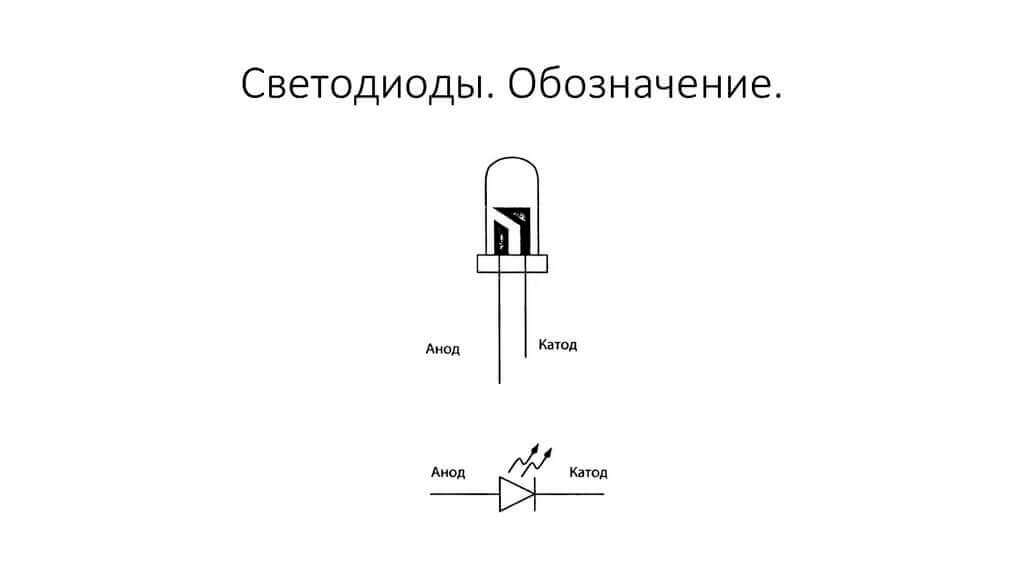
Електродите или краката на полупроводникови и вакуумни електронни устройства също често се наричат анод и катод. Помислете на диаграмата условното графично обозначение на полупроводников диод:
Както виждаме, анодът на диода е свързан с плюса на батерията. Така се нарича по същата причина - в този случай токът се влива в изхода на диода във всеки случай. На реален елемент върху катода има маркировка под формата на лента или точка.
Светодиодът е подобен. На 5 мм светодиоди вътрешностите се виждат през колбата. Половината, която е по-голяма, е катода.
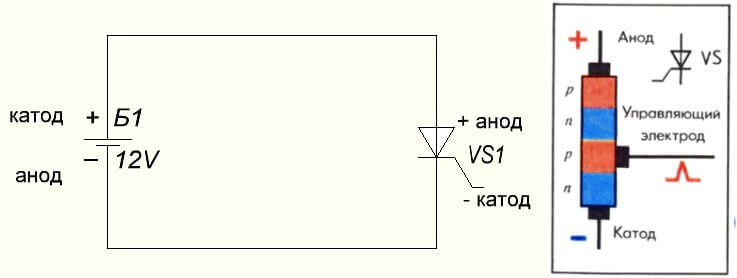
Ситуацията е и с тиристора, целта на заключенията и „еднополярното“ приложение на тези трикраки компоненти го превръщат в контролиран диод:
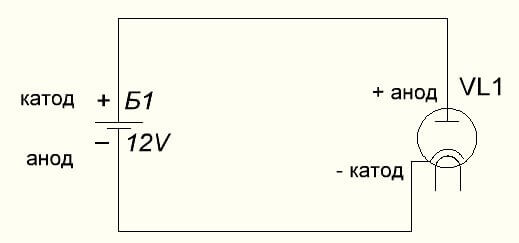
Вакуумният диод също свързва анода към плюса, а катода към минуса, което е показано на диаграмата по-долу. Въпреки че при прилагане на обратното напрежение имената на тези елементи няма да се променят, въпреки потока на електрически ток в обратна посока, макар и незначителен.
При пасивните елементи като кондензатори и резистори това не е така. Катодът и анодът не са изолирани отделно от резистора; токът в него може да тече във всяка посока. Можете да дадете каквото и да било име на неговите заключения, в зависимост от ситуацията и въпросната схема. Конвенционалните неполярни кондензатори също. По-рядко това разделяне на имената на контакт се наблюдава в електролитни кондензатори.
заключение
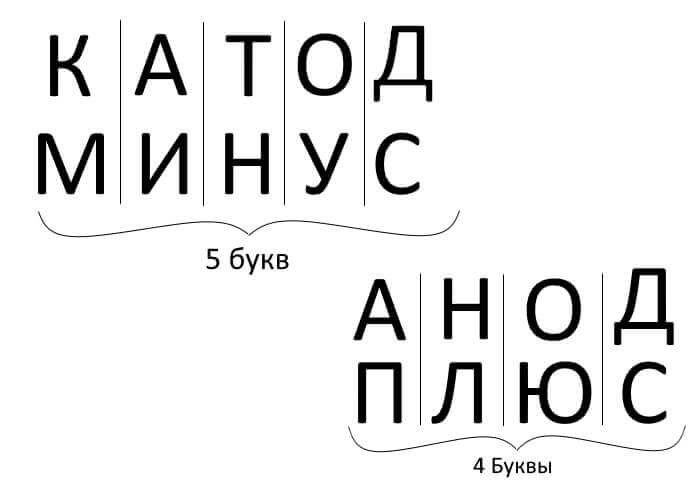
И така, да обобщим, отговаряйки на въпроса: как да запомните къде е плюсът, къде е минусът на катода с анода? Има удобно мнемонично правило за електролиза, заряд на батерията, галванопластика и полупроводникови устройства. Тези думи с подобни имена имат същия брой букви, както е илюстрирано по-долу:
Във всички тези случаи токът тече от катода и се влива в анода.
Не се обърквайте от объркването: „защо катодът е положителен за батерията и когато се зарежда, става отрицателен?“ Не забравяйте за всички елементи на електрониката, както и електролизаторите и при галванопластика - като цяло за всички консуматори на енергия анодът е изходът, свързан с плюса. Разликите свършват дотук, сега е по-лесно да разберете какъв е плюсът и минусът между изходите на елементите и устройствата.
И накрая, препоръчваме да гледате полезно видео по темата на статията:
Сега знаете какво са анодът и катодът, както и как да ги запомните достатъчно бързо. Надяваме се, че предоставената информация е била полезна и интересна за вас!
Свързани материали: