Vad är anoden och katoden - en enkel förklaring
Elektrokemi och elektroplätering
Det finns två huvudavsnitt i elektrokemi:
- Galvaniska celler - produktion av elektricitet genom en kemisk reaktion. Dessa element inkluderar batterier och ackumulatorer. De kallas ofta kemiska strömkällor.
- Elektrolys - påverkan på en kemisk reaktion med elektricitet, med enkla ord - med hjälp av en kraftkälla startas en reaktion.
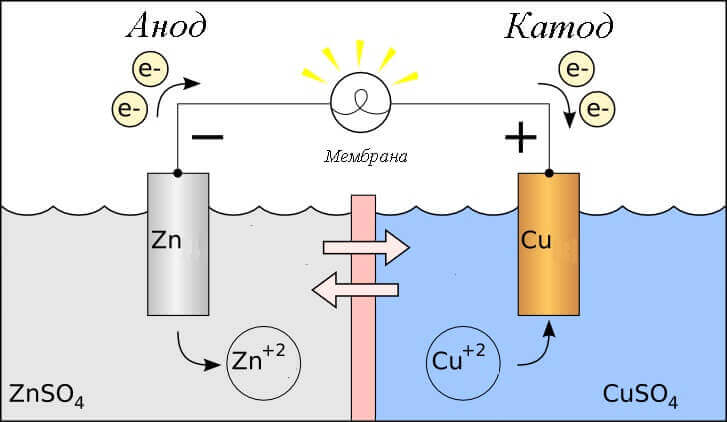
Tänk redoxreaktionen i en galvanisk cell, vilka processer inträffar på dess elektroder?
- Anod - elektroden som observeras oxidativ reaktiondet vill säga hanger elektroner. Elektroden på vilken oxidationsreaktionen inträffar kallas reduktionsmedel.
- Katod - elektroden som strömmar på återhämtningsreaktiondet vill säga hanaccepterar elektroner. Elektroden på vilken reduktionsreaktionen inträffar kallas oxidationsmedel.
Detta ger upphov till frågan - var är plus och var är batteriets minus? Baserat på definitionen av en galvanisk cell anod ger elektroner.
Viktig! GOST 15596-82 ger en officiell definition av namnen på slutsatserna från kemiska strömkällor, kort sagt, sedan plus vid katoden, och minus vid anoden.
I detta fall beaktas flödet av elektrisk ström. längs ledaren för den externa kretsen från oxidationsmedel (katod) till reduktant (anod). Eftersom elektronerna i kretsen flyter från minus till plus, och den elektriska strömmen är vice versa, är katoden ett plus, och anoden är en minus.
Uppmärksamhet: ström flyter alltid in i anoden!
Eller samma i diagrammet:
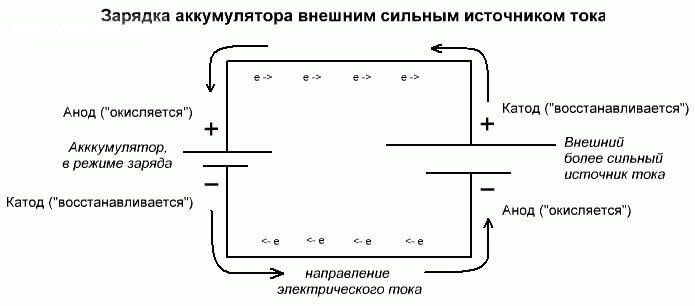
Batterielektrolys eller laddningsprocess
Dessa processer är likartade och omvända till den galvaniska cellen, eftersom här inte energi kommer från en kemisk reaktion, utan snarare en kemisk reaktion inträffar från en extern elkälla.
I detta fall kallas kraftkällan också katoden och minus anoden. Men kontakterna på den laddningsbara galvaniska cellen eller elektroderna i elektrolysatorn har redan motsatta namn, låt oss se varför!
Viktig! När en galvanisk cell laddas ut är anoden minus, katoden är plus och vice versa vid laddning.
Eftersom strömmen från den positiva terminalen i kraftkällan tillförs den positiva terminalen på batteriet, kan den senare inte längre vara en katod.Med hänvisning till ovanstående kan vi dra slutsatsen att i detta fall elektroderna på batteriet villkorligt byter plats vid laddning.
Sedan kallas den genom en elektrode i en laddad galvanisk cell till vilken en elektrisk ström flyter, en anod. Det visar sig att när batteriet laddas blir plus anoden och minus katoden.
Galvanisering
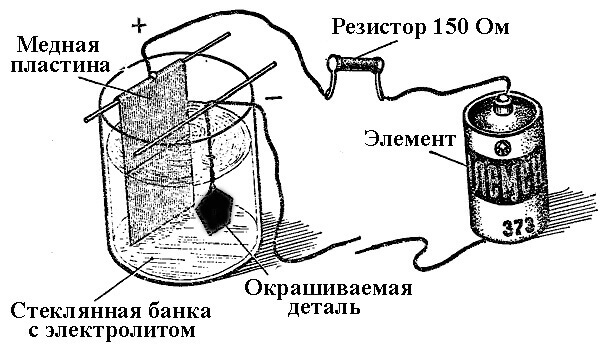
Processerna för metallavlagring som ett resultat av en kemisk reaktion under påverkan av en elektrisk ström (under elektrolys) kallas galvanisk teknik. Således fick världen förgyllt, förgyllt, förkromad eller andra metallpläterade smycken och detaljer. Denna process används både för dekorativa och tillämpade ändamål - för att förbättra korrosionsbeständigheten hos olika komponenter och mekanismer.
Principen för drift av galvaniseringsanläggningar ligger i användningen av lösningar av salter av elementen som täcker delen som en elektrolyt.
Vid elektroplätering är anoden också en elektrod till vilken den positiva utsignalen från kraftkällan är ansluten, katoden är i detta fall en minus. I detta fall avsätts (reduceras) metallen på den negativa elektroden (reduktionsreaktion). Det vill säga, om du vill göra en förgyllt ring med dina egna händer, anslut den negativa utmatningen från strömförsörjningen till den och placera den i en behållare med lämplig lösning.
Inom elektronik
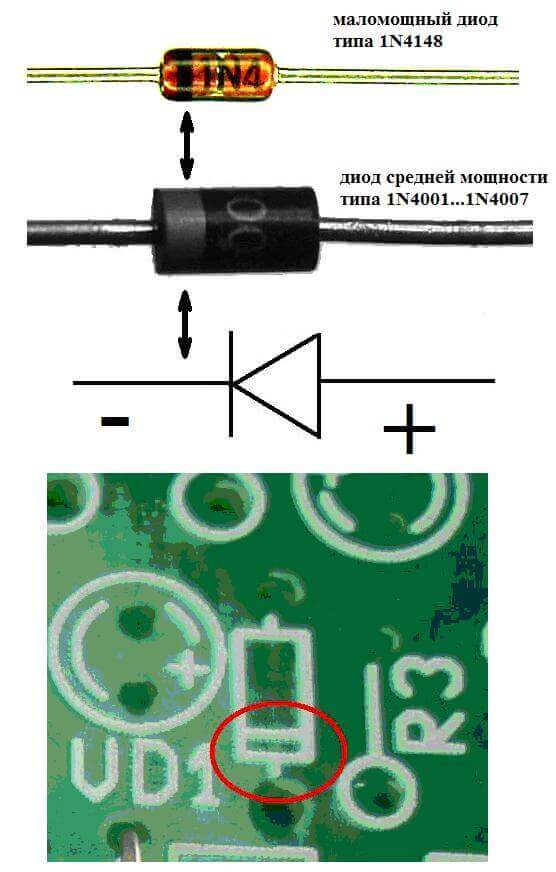
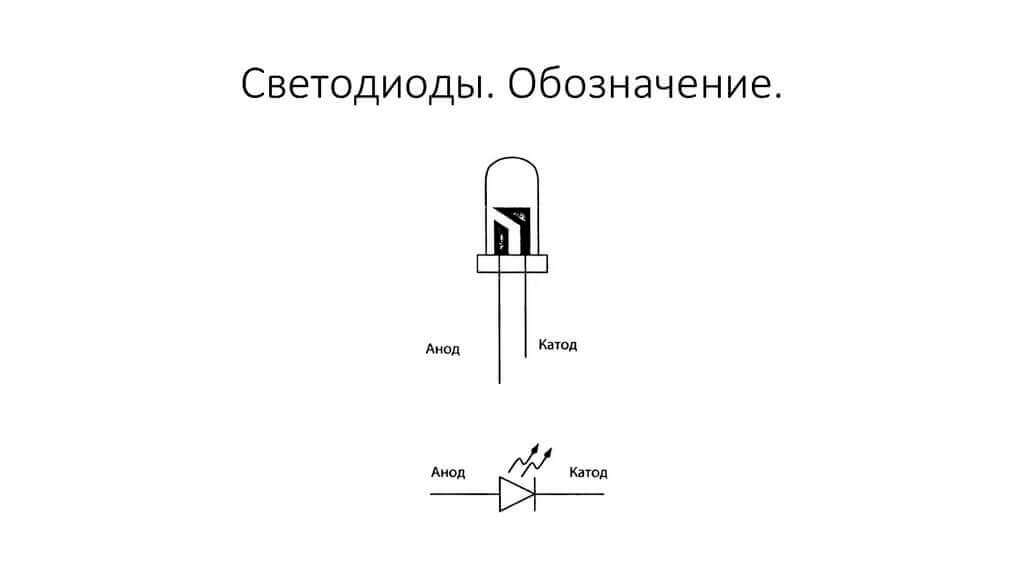
Elektroder eller ben av halvledare och vakuumelektroniska enheter kallas också ofta anoden och katoden. Tänk på den villkorade grafiska beteckningen för en halvledardiod i diagrammet:
Som vi ser är anodens anod ansluten till batteriets plus. Det kallas så av samma anledning - i det här fallet flyter strömmen in i diodens utgång i alla fall. På ett riktigt element på katoden finns det en markering i form av en remsa eller en prick.
Lysdioden liknar. På 5 mm lysdioder är insidan synlig genom kolven. Halvan som är större är katoden.
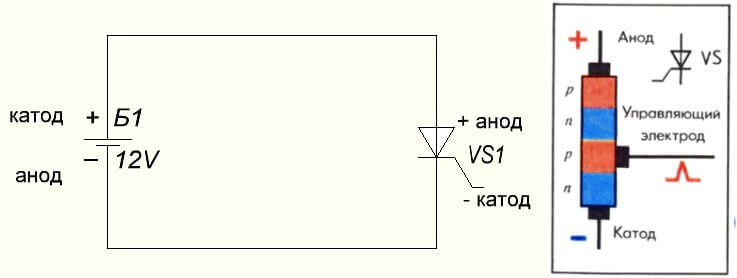
Situationen är också med tyristorn, syftet med slutsatserna och den "unipolära" tillämpningen av dessa trebensdelar gör det till en kontrollerad diod:
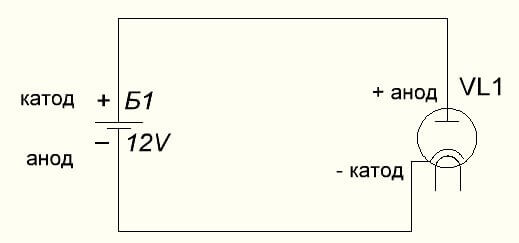
Vakuumdioden ansluter också anoden till plus och katoden till minus, vilket visas i diagrammet nedan. Även om man använder omvänd spänning kommer namnen på dessa element inte att ändras, trots flödet av elektrisk ström i motsatt riktning, om än obetydlig.
Med passiva element som kondensatorer och motstånd är detta inte fallet. Katoden och anoden isoleras inte separat från motståndet, strömmen i den kan flöda i någon riktning. Du kan ge valfritt namn på dess slutsatser, beroende på situationen och schemat i fråga. Konventionella icke-polära kondensatorer. Mindre vanligt observeras denna separering av kontaktnamn i elektrolytiska kondensatorer.
Slutsats
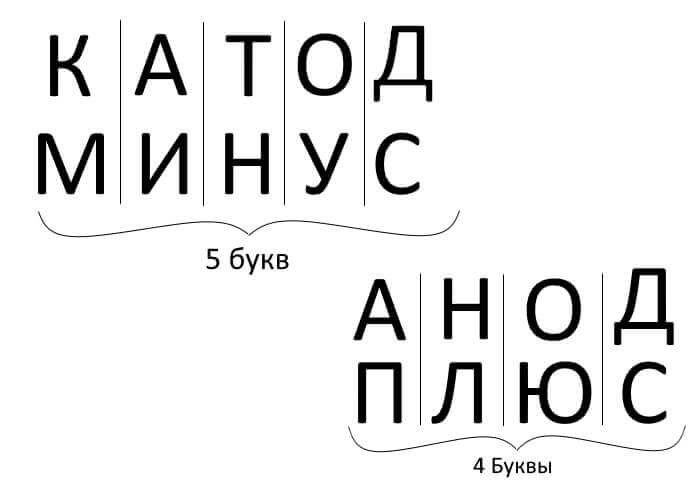
Så, för att sammanfatta, svara på frågan: hur man kommer ihåg var är plus, var är katoden minus med anoden? Det finns en bekväm mnemonisk regel för elektrolys, batteriladdning, elektroplätering och halvledaranordningar. Dessa ord med liknande namn har samma antal bokstäver, som illustreras nedan:
I alla dessa fall flyter strömmen från katoden och flyter in i anoden.
Var inte förvirrad av förvirringen: "varför är katoden positiv för batteriet, och när det laddas blir det negativt?" Kom ihåg för alla elektronikelement, såväl som elektrolysatorer och i elektroplätering - i allmänhet, för alla energikonsumenter, är anoden den utgång som är ansluten till plus. Skillnaderna slutar där, nu är det lättare för dig att ta reda på vad som är plus och minus mellan utgångarna till elementen och enheterna.
Slutligen rekommenderar vi att du tittar på en användbar video om artikelns ämne:
Nu vet du vad anoden och katoden är, liksom hur du memorerar dem tillräckligt snabbt. Vi hoppas att informationen var användbar och intressant för dig!
Relaterade material: