Apakah anod dan katod - penjelasan ringkas
Elektrokimia dan Elektroplating
Terdapat dua bahagian utama dalam elektrokimia:
- Sel galvanik - penghasilan elektrik melalui tindak balas kimia. Unsur-unsur ini merangkumi bateri dan penumpuk. Mereka sering dipanggil sumber arus kimia.
- Elektrolisis - kesan terhadap tindak balas kimia dengan elektrik, dengan kata mudah - dengan bantuan sumber kuasa, tindak balas dimulakan.
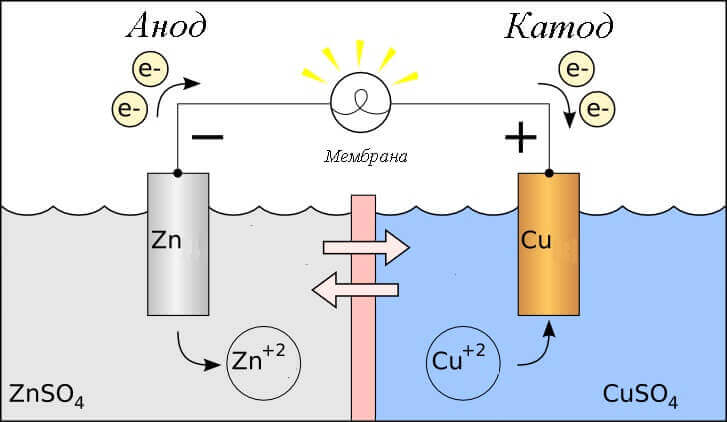
Pertimbangkan tindak balas redoks dalam sel galvanik, maka proses apa yang berlaku pada elektrodnya?
- Anod - elektrod yang diperhatikan tindak balas oksidatifiaitu, diamemberikan elektron. Elektrod di mana tindak balas pengoksidaan berlaku dipanggil agen pengurangan.
- Katod - elektrod yang mengalir reaksi pemulihaniaitu, diamenerima elektron. Elektrod di mana tindak balas pengurangan berlaku dipanggil agen pengoksidaan.
Ini menimbulkan persoalan - di mana nilai tambah, dan di mana tolak bateri? Berdasarkan definisi sel galvanik anod memberikan elektron.
Penting! GOST 15596-82 memberikan definisi rasmi mengenai nama-nama kesimpulan sumber arus kimia, pendeknya, kemudian tambah pada katod, dan tolak pada anod.
Dalam kes ini, aliran arus elektrik dipertimbangkan. di sepanjang litar luaran dari pengoksidaan (katod) ke pengurangan (anod). Oleh kerana elektron dalam litar mengalir dari minus ke plus, dan arus elektrik sebaliknya, maka katod adalah tambah, dan anod adalah minus.
Perhatian: arus sentiasa mengalir ke anod!
Atau sama dalam rajah:
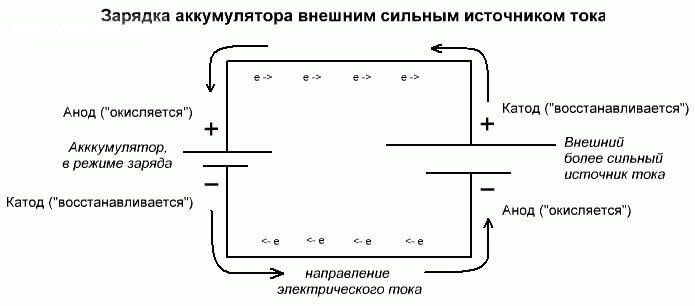
Proses elektrolisis atau pengecasan bateri
Proses-proses ini serupa dan terbalik dengan sel galvanik, kerana di sini bukan tenaga berasal dari reaksi kimia, melainkan reaksi kimia berlaku dari sumber elektrik luaran.
Dalam kes ini, ditambah bekalan kuasa juga disebut katod, dan tolak anod. Tetapi kenalan sel galvanik atau elektrod elektrolisis yang boleh dicas semula sudah mempunyai nama yang berlawanan, mari kita lihat mengapa!
Penting! Apabila sel galvanik dilepaskan, anodnya negatif, katod ditambah, dan sebaliknya semasa mengecas.
Oleh kerana arus dari terminal positif sumber kuasa dibekalkan ke terminal positif bateri, yang terakhir tidak lagi boleh menjadi katod.Dengan merujuk kepada perkara di atas, kita dapat menyimpulkan bahawa dalam hal ini elektrod bateri secara bersyarat berubah tempat ketika mengecas.
Kemudian, melalui elektrod sel galvanik bermuatan ke mana arus elektrik mengalir, ia dipanggil anod. Ternyata ketika mengecas bateri, tambah menjadi anoda, dan tolak katod.
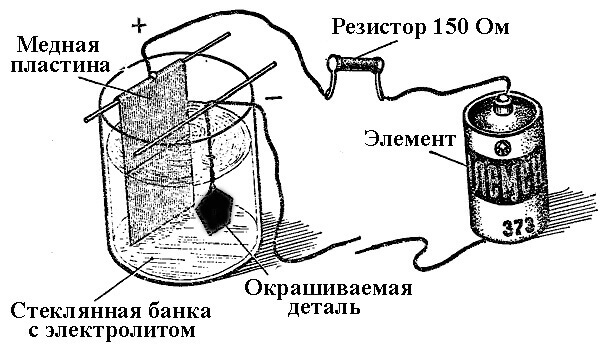
Penyaduran elektrik
Proses pemendapan logam akibat tindak balas kimia di bawah pengaruh arus elektrik (semasa elektrolisis) disebut kejuruteraan galvanik. Oleh itu, dunia menerima perhiasan dan perincian berlapis perak, emas, berlapis krom atau berlapis logam yang lain. Proses ini digunakan baik untuk hiasan dan untuk tujuan penggunaan - untuk meningkatkan ketahanan kakisan pelbagai komponen dan pemasangan mekanisme.
Prinsip operasi loji penyaduran terletak pada penggunaan larutan garam unsur-unsur yang akan menutup bahagian tersebut sebagai elektrolit.
Dalam penyaduran elektrik, anoda juga merupakan elektrod yang dihubungkan dengan output positif sumber kuasa, katod dalam kes ini adalah tolak. Dalam kes ini, logam didepositkan (dikurangkan) pada elektrod negatif (reaksi pengurangan). Maksudnya, jika anda ingin membuat cincin berlapis emas dengan tangan anda sendiri - sambungkan output negatif bekalan kuasa ke dalamnya dan letakkan di dalam bekas dengan penyelesaian yang sesuai.
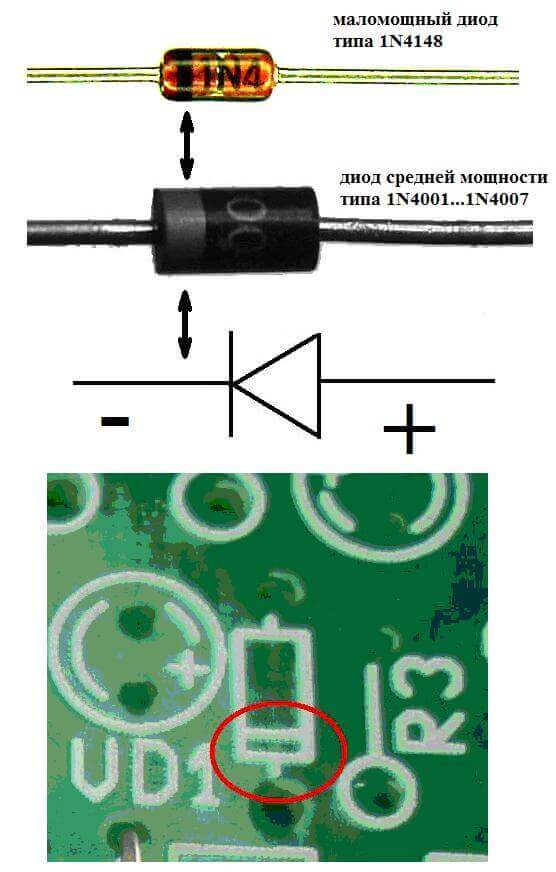
Dalam elektronik
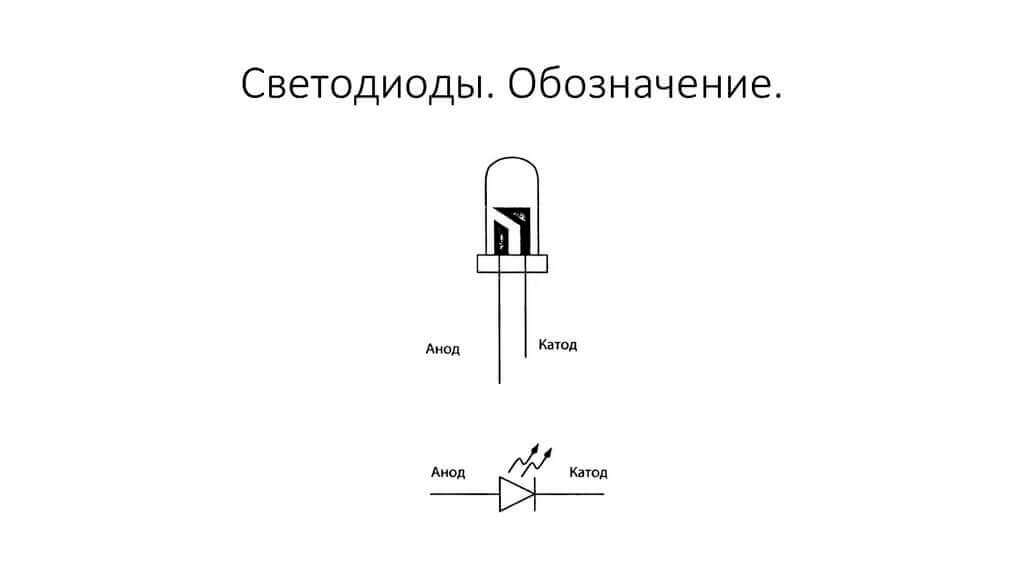
Elektrod atau kaki alat elektronik semikonduktor dan vakum juga sering disebut anod dan katod. Pertimbangkan sebutan grafik bersyarat bagi diod semikonduktor dalam rajah:
Seperti yang kita lihat, anoda diod disambungkan ke tambah bateri. Ia dipanggil untuk alasan yang sama - dalam kes ini, arus mengalir ke output diod dalam keadaan apa pun. Pada elemen sebenar pada katod terdapat tanda dalam bentuk jalur atau titik.
LED serupa. Pada LED 5 mm, bahagian dalam dapat dilihat melalui termos. Separuh yang lebih besar adalah katod.
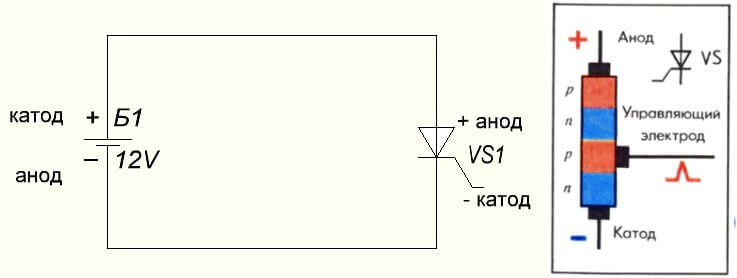
Situasinya juga berlaku dengan thyristor, tujuan kesimpulan dan aplikasi "unipolar" komponen berkaki tiga ini menjadikannya diod terkawal:
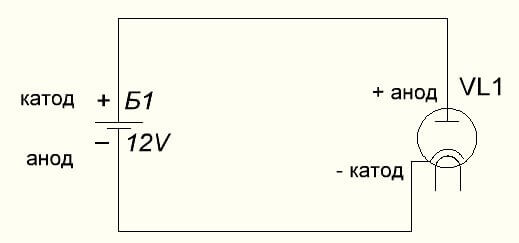
Diod vakum juga menghubungkan anod ke tambah, dan katod ke tolak, yang ditunjukkan dalam rajah di bawah. Walaupun semasa menggunakan voltan terbalik, nama unsur-unsur ini tidak akan berubah, walaupun aliran arus elektrik ke arah yang bertentangan, walaupun tidak signifikan.
Dengan elemen pasif seperti kapasitor dan perintang, ini tidak berlaku. Katod dan anod tidak diasingkan secara terpisah dari perintang; arus di dalamnya dapat mengalir ke arah mana pun. Anda boleh memberikan apa-apa nama pada kesimpulannya, bergantung pada keadaan dan skema yang dimaksudkan. Kapasitor bukan kutub konvensional juga. Lebih jarang, pemisahan nama kenalan ini diperhatikan dalam kapasitor elektrolitik.
Kesimpulannya
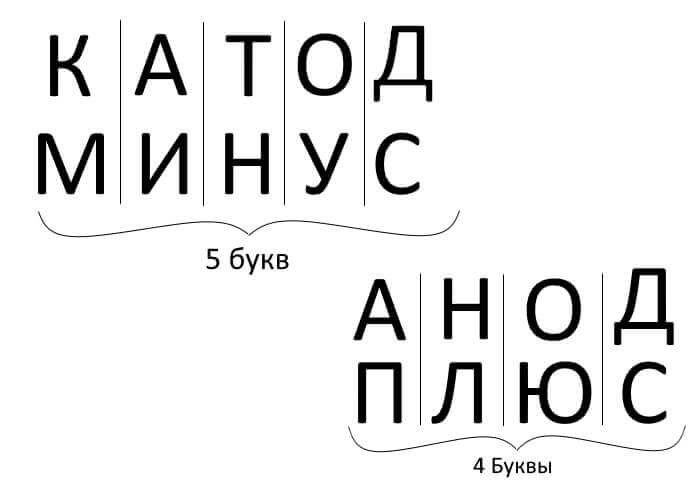
Jadi, untuk meringkaskan, menjawab soalan: bagaimana mengingat di mana nilai tambah, di mana minus katod dengan anod? Terdapat peraturan mnemonik yang mudah untuk elektrolisis, cas bateri, penyaduran elektrik dan peranti semikonduktor. Kata-kata ini dengan nama yang serupa mempunyai jumlah huruf yang sama, seperti yang digambarkan di bawah:
Dalam semua kes ini, arus mengalir dari katod, dan mengalir ke anod.
Jangan keliru dengan kekeliruan: "mengapa katod positif untuk bateri, dan apabila ia diisi, adakah ia menjadi negatif?" Ingatlah untuk semua elemen elektronik, serta elektrolisis dan dalam penyaduran elektrik - secara amnya, untuk semua pengguna tenaga, anod adalah output yang dihubungkan dengan nilai tambah. Perbezaannya berakhir di sini, sekarang lebih mudah bagi anda untuk mengetahui apakah nilai tambah dan tolak antara output elemen dan peranti.
Akhirnya, kami mengesyorkan menonton video yang berguna mengenai topik artikel:
Sekarang anda tahu apa anod dan katod, serta cara mengingatnya dengan cukup cepat. Kami harap maklumat yang diberikan berguna dan menarik untuk anda!
Bahan berkaitan: