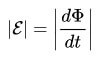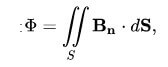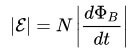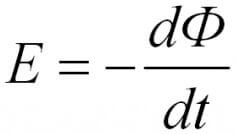החוקים של פאראדיי בכימיה ופיזיקה - הסבר קצר במילים פשוטות
סיפור גילוי
החוק של פאראדיי בתחום האלקטרודינמיקה התגלה על ידי שני מדענים: מייקל פאראדיי וג'וזף הנרי, אך פאראדיי פרסם את תוצאות עבודתו מוקדם יותר - בשנת 1831.
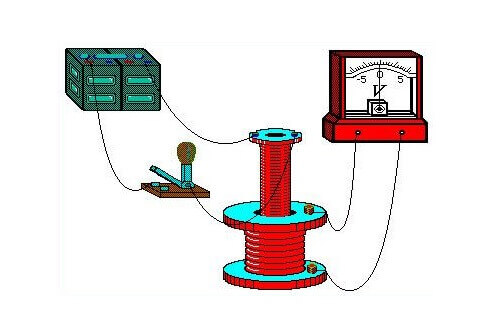
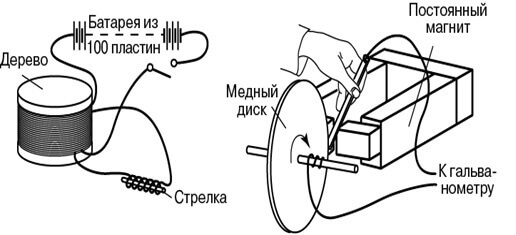
בניסויי ההדגמה שלו באוגוסט 1831, הוא השתמש בתור ברזל, שבקצותיו הנגדיים נפתל חוט (חוט אחד לכל צד). הוא סיפק חשמל לקצוות של חוט ראשון אחד מסוללה גלוונית, וחיבר גלוונומטר למסופי השני. העיצוב היה דומה לשנאי מודרני. מעת לעת לכבות ולכבות את המתח על החוט הראשון, הוא הבחין בגלים בגולוונומטר.
גלווניומטר הוא מכשיר רגיש ביותר למדידת חוזק זרמים קטנים.
בדרך זו הוצגה השפעת השדה המגנטי שנוצר בזרימת הזרם בחוט הראשון על מצב המוליך השני. אפקט זה הועבר מהראשון לשני דרך הליבה - טורוס מתכת. כתוצאה ממחקר, התגלתה גם השפעתו של מגנט קבוע, שנע בסליל, על סלילתו.
ואז פאראדיי הסביר את תופעת האינדוקציה האלקטרומגנטית מבחינת קווי כוח. אחד נוסף היה ההתקנה ליצירת זרם ישר: דיסק נחושת הסתובב בסמוך למגנט, והחוט שהחליק לאורכו היה אספן זרם. ההמצאה הזו נקראת הדיסק של פאראדיי.
מדענים מאותה תקופה לא הכירו ברעיונותיו של פאראדיי, אך מקסוול לקח את המחקר על בסיס התיאוריה המגנטית שלו. בשנת 1836, מייקל פאראדיי הקים מערכות יחסים לתהליכים אלקטרוכימיים, אשר נקראו חוקי האלקטרוליזה של פאראדיי. הראשון מתאר את יחסי מסת החומר שהוקצה לאלקטרודה והזרם הזורם, והשני מתאר את יחסי מסת החומר בתמיסה ואת מסת החומר המבודד על האלקטרודה לכמות מסוימת של חשמל.
אלקטרודנמיקה
העבודות הראשונות מיושמות בפיזיקה, במיוחד בתיאור פעולתן של מכונות ומכשירים חשמליים (שנאים, מנועים וכו '). החוק של פאראדיי קובע:
עבור מעגל, ה- EMF המושרה הוא ביחס ישר לגודל המהירות של השטף המגנטי, העובר במעגל זה עם סימן מינוס.
ניתן לומר זאת במילים פשוטות: ככל שהשטף המגנטי נע במהירות דרך המעגל, נוצר יותר EMF במסופים שלו.
הנוסחה היא כדלקמן:
כאן dF הוא השטף המגנטי, ו- dt הוא יחידת הזמן. ידוע שנגזרת הפעם הראשונה היא מהירות.כלומר, מהירות השטף המגנטי במקרה מסוים זה. אגב, הוא יכול לנוע, כמו מקור לשדה מגנטי (סליל עם זרם - אלקטרומגנט, או מגנט קבוע), ומעגל.
כאן ניתן לבטא את הזרימה על ידי הנוסחה הבאה:
B הוא השדה המגנטי, ו- dS הוא שטח הפנים.
אם ניקח בחשבון סליל עם סיבובי פצעים חזק, בעוד שמספר הפניות N, אז החוק של פאראדיי הוא כדלקמן:
שטף מגנטי בנוסחה של מהפכה אחת, נמדד בוובר. הזרם הזורם במעגל נקרא אינדוקציה.
אינדוקציה אלקטרומגנטית היא תופעה של זרימת זרם במעגל סגור בהשפעת שדה מגנטי חיצוני.
בנוסחאות למעלה ניתן היה להבחין בסימני המודול, בלעדיהם יש מראה מעט שונה, כמו שנאמר בניסוח הראשון, עם סימן מינוס.
סימן המינוס מסביר את כלל הלנז. הזרם העולה במעגל יוצר שדה מגנטי, הוא מכוון הפוך. זו תוצאה של חוק שימור האנרגיה.
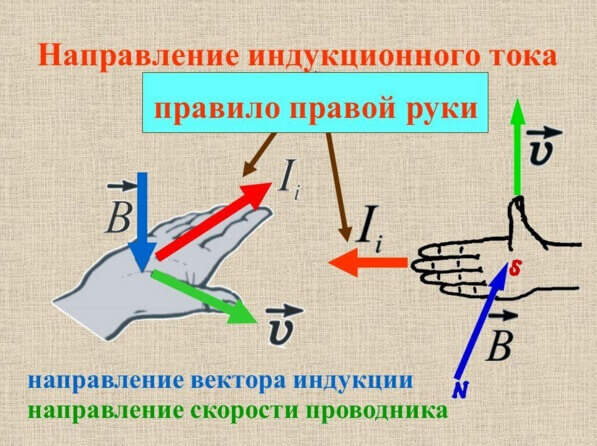
ניתן לקבוע את כיוון זרם הגיוס על ידי הכלל של יד ימין או גימלט, בחנו את זה באתר שלנו בפירוט.
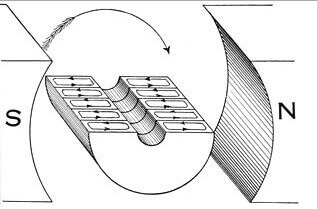
כאמור, בגלל תופעת האינדוקציה האלקטרומגנטית עובדים מכונות חשמליות, שנאים, גנרטורים ומנועים. האיור מציג את זרימת הזרם בבית הנורה המתפתל בהשפעת השדה המגנטי של הסטטור. במקרה של הגנרטור, כאשר הרוטור מסתובב על ידי כוחות חיצוניים, מופיע EMF בסיבובי הרוטור, הזרם מייצר שדה מגנטי המכוון בכיוון ההפוך (אותו סימן מינוס בנוסחה). ככל שהזרם הנצרך בעומס הגנרטור גדול יותר, השדה המגנטי גדול יותר, וסיבובו קשה יותר.
ולהיפך - כאשר הזרם זורם ברוטור, מופיע שדה שמתקשר עם שדה הסטטור והרוטור מתחיל להסתובב. עם עומס על הפיר, הזרם בסטטור וברוטור עולה, ויש צורך להבטיח את החלפת הרוחות, אך זהו נושא נוסף שקשור לסידור מכונות חשמל.
בלב פעולתו של השנאי, מקור השטף המגנטי הנע הוא שדה מגנטי מתחלף הנובע מזרימת זרם חילופין בהתפתלות הראשונית.
אם ברצונך ללמוד את הנושא ביתר פירוט, אנו ממליצים לצפות בווידיאו שעליו מתואר בקלות ובקלות חוק פאראדיי לאינדוקציה אלקטרומגנטית:
אלקטרוליזה
בנוסף למחקר על EMF וגירוי אלקטרומגנטי, המדען גילה תגליות נהדרות בתחומים אחרים, כולל כימיה.
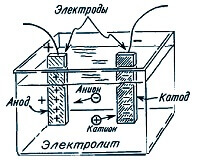
כאשר זרם זורם דרך האלקטרוליט, יונים (חיוביים ושליליים) מתחילים למהר אל האלקטרודות. מעבר שלילי לאנודה, חיובי לקתודה. במקביל, מסה מסוימת של החומר הכלול באלקטרוליט משתחררת על אחת האלקטרודות.
פאראדיי ביצע ניסויים, העביר זרם שונה דרך האלקטרוליט ומדידת המסה של החומר שהופקד על האלקטרודות, הסיק את הדפוסים.
m = k * Q
m הוא המסה של החומר, q הוא המטען, ו- k תלוי בהרכב האלקטרוליט.
חיוב יכול להתבטא במונחים של זרם לאורך פרק זמן:
I = q / tאז q = i * t
כעת תוכלו לקבוע את מסת החומר שישוחרר, לדעת את הזרם ואת השעה שהוא זרם. זה נקרא החוק הראשון של פאראדיי אלקטרוליזה.
החוק השני:
המסה של היסוד הכימי שמתיישב על האלקטרודה עומדת ביחס ישר למסה המקבילה של היסוד (מסה טוחנת המחולקת במספר שתלוי בתגובה הכימית בה מעורב החומר).
בהתבסס על האמור לעיל, חוקים אלה משולבים לנוסחה:
m הוא המסה של החומר ששוחרר בגרמים, n הוא מספר האלקטרונים שהועברו בתהליך האלקטרודה, F = 986485 C / mol הוא המספר של פאראדיי, t הוא הזמן בשניות, M הוא המסה הטוחנית של החומר g / mol.
במציאות, מסיבות שונות, מסת החומר המשוחרר נמוכה מהמחושב (בעת חישוב הזרימה הנוכחית). היחס בין ההמונים התיאורטיים והממשיים נקרא יעילות שוטפת:
בt = 100% * מ 'חישוב/ מתיאוריה
ולבסוף, אנו ממליצים שתבחן הסבר מפורט על חוק פאראדיי לאלקטרוליזה:
חוקי פאראדיי תרמו תרומה משמעותית להתפתחות המדע המודרני, בזכות עבודתו יש לנו מנועים חשמליים וגנרטורים חשמליים (כמו גם עבודת חסידיו). העבודה של EMF והתופעות של אינדוקציה אלקטרומגנטית העניקו לנו את רוב הציוד החשמלי המודרני, כולל רמקולים ומיקרופונים, שבלעדיהם אי אפשר להאזין להקלטות ותקשורת קולית. תהליכי אלקטרוליזה משמשים בשיטה הגלוונית של חומרי ציפוי, הנושאת גם ערך דקורטיבי וגם ערך מעשי.
חומרים דומים: