Mi az anód és a katód - egyszerű magyarázat
Elektrokémia és galvanizálás
Az elektrokémia két fő részből áll:
- Galván cellák - villamos energia előállítása kémiai reakció révén. Ezek az elemek tartalmazzák az elemeket és akkumulátorokat. Ezeket gyakran kémiai áramforrásoknak nevezik.
- Elektrolízis - a villamos energiával történő kémiai reakcióra gyakorolt hatás, egyszerű szavakkal - egy energiaforrás segítségével egy reakció indul.
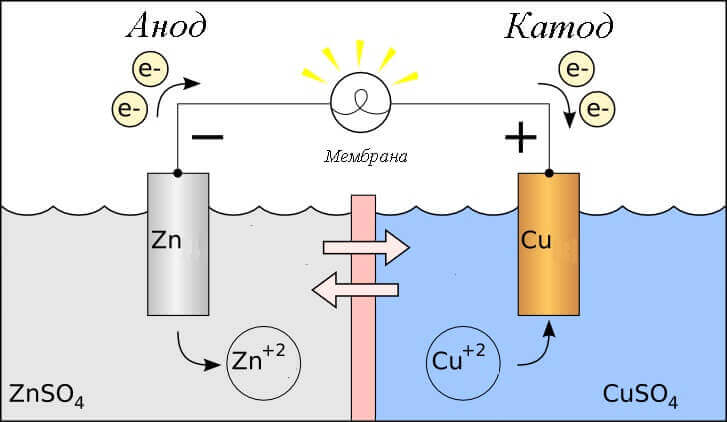
Vegye figyelembe a galvanikus cella redox reakcióját, akkor milyen folyamatok zajlanak az elektródáin?
- anód - az elektród, amelyen megfigyelték oxidatív reakcióvagyis őelektronokat ad. Az elektródot, amelyen az oxidációs reakció zajlik, nevezzük redukálószer.
- katód - az elektróda, amelyen áramlik visszanyerési reakcióvagyis őelektronokat fogad el. Az elektródot, amelyen a redukciós reakció zajlik, nevezzük oxidálószer.
Ez felteszi a kérdést - hol van a plusz, és hol van az akkumulátor mínusz? A galván cella meghatározása alapján az anód elektronokat ad.
Fontos! A GOST 15596-82 megadja a kémiai áramforrások következtetéseinek hivatalos meghatározását, röviden, plusz a katódnál és mínusz az anódnál.
Ebben az esetben az elektromos áram áramlását vesszük figyelembe. a külső áramkör vezetője mentén -tól oxidálószer (katód) hogy redukálószer (Anód). Mivel az áramkörben lévő elektronok mínuszról pluszra áramolnak, és az elektromos áram fordítva van, akkor a katód plusz, az anód pedig mínusz.
Figyelmeztetés: az áram mindig az anódba áramlik!
Vagy ugyanaz a diagramban:
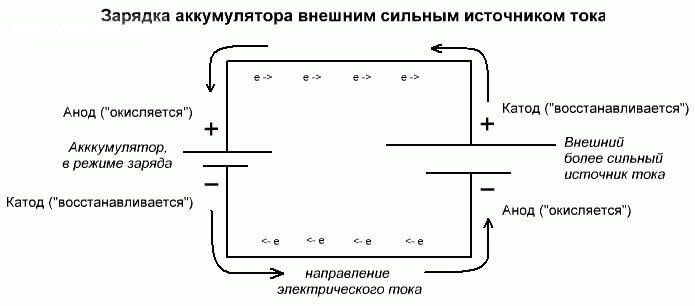
Az akkumulátor elektrolízise vagy töltése
Ezek a folyamatok hasonlóak és inverzek a galván cellához, mivel itt nem az energia származik kémiai reakcióból, hanem inkább - egy kémiai reakció egy külső áramforrás miatt következik be.
Ebben az esetben a tápegységet katódnak nevezzük, és mínusz az anódot. De az újratölthető galván cella vagy az elektrolizátor elektródjai már ellentétes névvel rendelkeznek, lássuk miért!
Fontos! Ha galváncellát ürít, az anód mínusz, a katód plusz, és fordítva töltéskor.
Mivel az energiaforrás pozitív kivezetéséből származó áramot továbbítják az akkumulátor pozitív kivezetésére, az utóbbi már nem lehet katód.A fentiekre hivatkozva arra a következtetésre juthatunk, hogy ebben az esetben az akkumulátor elektródjai feltételesen helyet cserélnek töltés közben.
Ezután egy töltött galvanikus elem elektródján keresztül, amelybe áramlik az elektromos áram, anódnak nevezzük. Kiderül, hogy az akkumulátor töltésekor a plusz anódmá válik, mínusz a katód.
galvanotechnikához
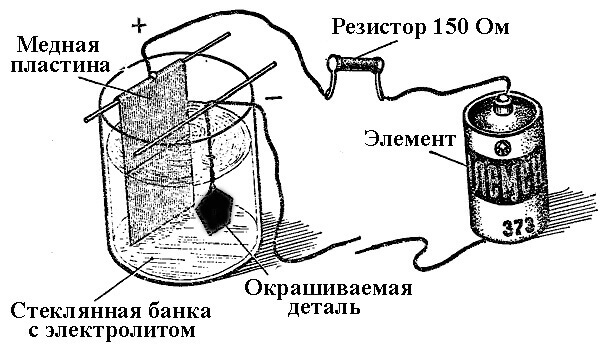
A fémlerakódási folyamatokat kémiai reakció eredményeként egy elektromos áram hatására (az elektrolízis során) galvanikus mérnöki eljárásnak nevezzük. Így a világ ezüstözött, aranyozott, krómozott vagy más fémmel bevont ékszereket és alkatrészeket kapott. Ezt a folyamatot dekoratív célokra és alkalmazási célokra egyaránt használják - a különféle alkatrészek és a mechanizmusok összeszerelésének korrózióállóságának javítására.
A galvanizáló berendezések működésének alapelve az elemek sóoldatának felhasználása, amely az elemet elektrolitként takarja le.
Galvanizáláskor az anód olyan elektróda is, amelyhez az áramforrás pozitív kimenete kapcsolódik, illetve a katód ebben az esetben mínusz. Ebben az esetben a fém lerakódik (redukálódik) a negatív elektródon (redukciós reakció). Vagyis ha saját kezével szeretne készíteni egy aranyozott gyűrűt - csatlakoztassa az áramellátás negatív kimenetét, és tegye egy megfelelő tartályba.
Az elektronikában
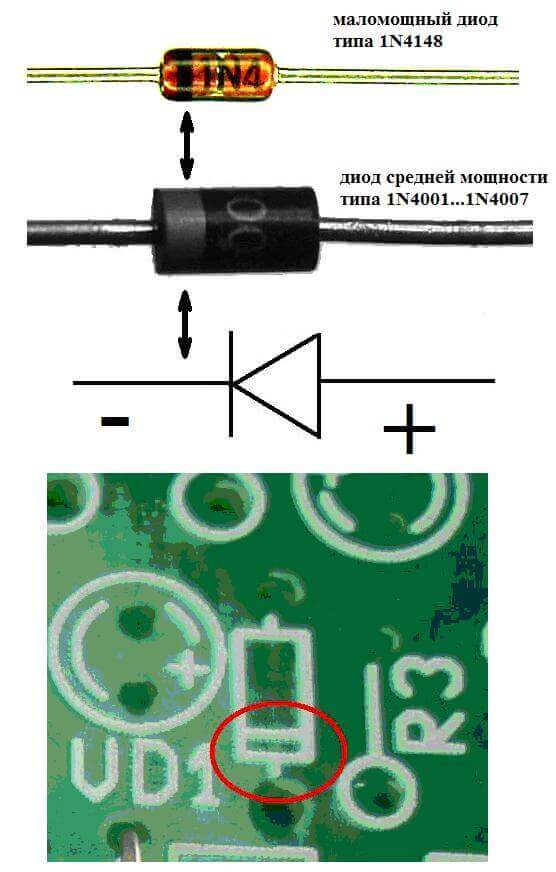
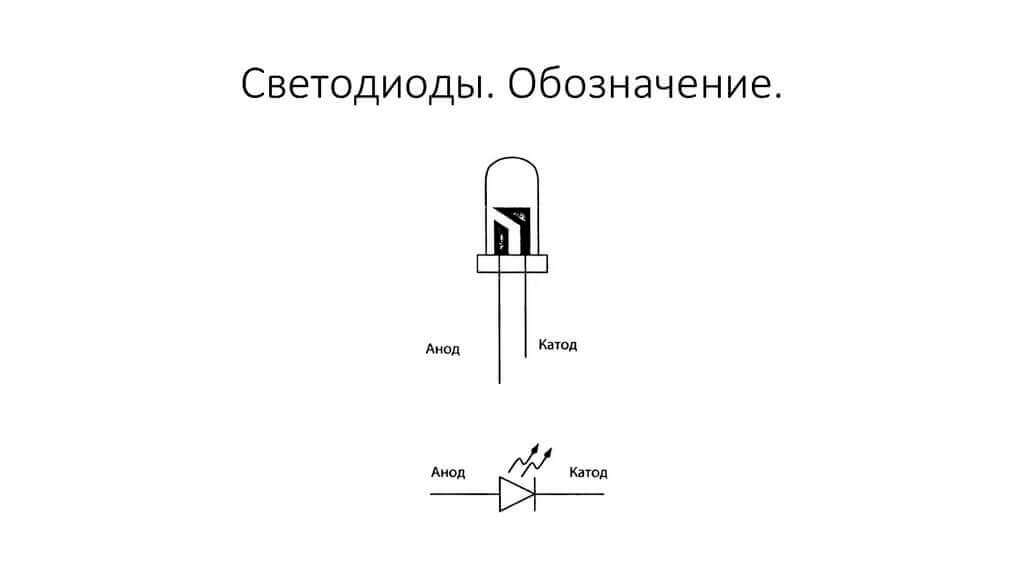
A félvezető és vákuum elektronikai eszközök elektródjait vagy lábait gyakran anódnak és katódnak is nevezik. Vegye figyelembe a félvezető dióda feltételes grafikus megnevezését az ábrán:
Mint látjuk, a dióda anódja az akkumulátor pluszjához van csatlakoztatva. Ugyanezen okból hívják, és ebben az esetben az áram mindenképpen a dióda kimenetébe áramlik. A katód valódi elemén van egy jelölés szalag vagy pont formájában.
A LED hasonló. 5 mm-es LED-eknél a belső részek a lombikon keresztül láthatók. A nagyobb, mint a katód.
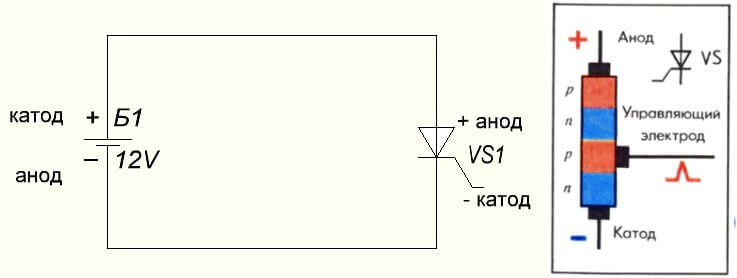
A helyzet a tirisztorral is, a következtetések célja és e háromlábú elemek „unipoláris” alkalmazása ellenőrzött diódává teszi:
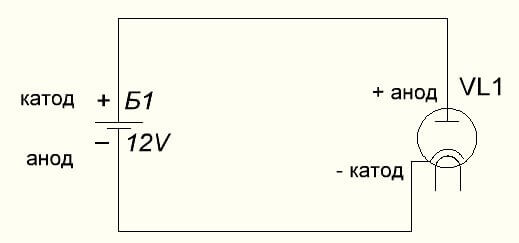
A vákuumdióda az anódot a pluszhoz, a katódot pedig a mínuszhoz köti, amelyet az alábbi ábra mutat. Bár fordított feszültség alkalmazásakor ezeknek az elemeknek a neve nem változik, annak ellenére, hogy az elektromos áram ellenkező irányba áramlik, bár jelentéktelen.
Passzív elemek, például kondenzátorok és ellenállások esetén nem ez a helyzet. A katód és az anód nincs elkülönítve az ellenállástól, az abban levő áram bármilyen irányban áramolhat. A következtetésekhez bármilyen nevet adhat, a helyzettől és a kérdéses rendszertől függően. Hagyományos nem poláros kondenzátorok is. Ritkábban az érintkező nevek szétválasztását figyeljük meg az elektrolitkondenzátorokban.
következtetés
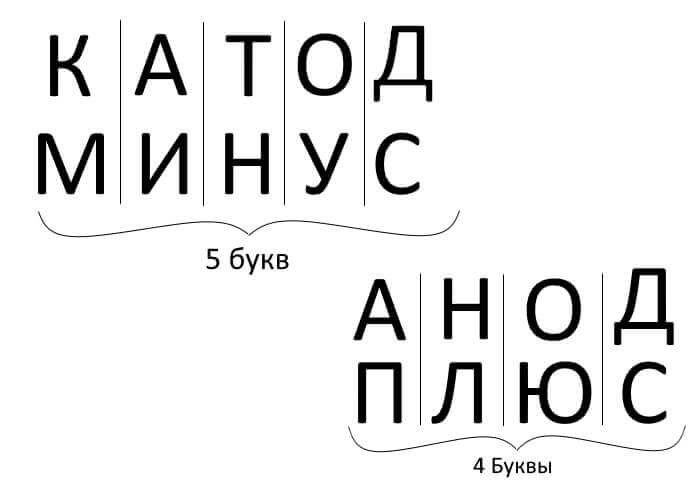
Tehát összefoglalva, válaszolva a kérdésre: hogyan emlékszem, hol van a plusz, hol van a mínusz a katód és az anód között? Van egy kényelmes mnemonikus szabály az elektrolízishez, az akkumulátor töltéséhez, galvanizáláshoz és félvezető eszközökhöz. Ezeknek a hasonló nevekkel rendelkező szavaknak azonos számú betűjük van, az alábbiak szerint:
Ezekben az esetekben az áram a katódból és az anódba áramlik.
Ne tévessze be a zavart: "Miért pozitív az akkumulátor katódja, és töltéskor negatívvá válik?" Ne felejtse el az elektronika minden elemét, valamint az elektrolizátorokat és a galvanizálást - általában minden energiafogyasztó számára az anód a pluszhoz csatlakoztatott kimenet. A különbségek itt véget érnek, most könnyebb kiszámítani, hogy mi az plusz és mínusz az elemek és eszközök kimenetei között.
Végül azt javasoljuk, hogy nézzen meg egy hasznos videót a cikk témájáról:
Most már tudja, mi az anód és a katód, valamint hogy miként emlékezzen rájuk elég gyorsan. Reméljük, hogy a nyújtott információ hasznos és érdekes volt az Ön számára!
Kapcsolódó anyagok: